Un investigador de la Universidad de Burgos avanza en la mejora de los tratamientos de quimioterapia contra el cáncer
El objetivo de esta investigación es aumentar la precisión para eliminar células cancerosas y reducir el daño a las células sanas

El investigador de la UBU Roberto Quesada explica los avances de su proyecto
Castilla y León - Publicado el - Actualizado
3 min lectura
En ocasiones, cuando hablamos de avances en la cura del cáncer, esos nuevos estudios o investigaciones se centran en la mejora de la quimioterapia. Este tratamiento ha avanzado mucho en las últimas décadas para convertirse en una quimioterapia mucho más personalizada para cada caso, y mucho más selectiva.
Es decir, la mejora de la quimioterapia pasa por destruir con más efectividad las células afectadas por el cáncer, y además reducir el impacto negativo que tiene en las células sanas, que claro, también se ven afectadas.
Uno de esos avances tiene como protagonista a un investigador de la Universidad de Burgos, Roberto Quesada. Este científico está elaborando un estudio centrado en esta eliminación selectiva de celulosas cancerosas. El objetivo es dar con determinados compuestos que permitan esta eliminación selectiva.

La revista 'Cell Reports Physical Science' ha publicado este estudio que propone el uso de ‘jaulas’ moleculares para eliminar células cancerosas de forma selectiva en microambientes ácidos. Para ello se ha realizado un estudio exhaustivo con una familia amplia de ‘jaulas’ para entender cómo actúan. El trabajo está liderado por un equipo científico del Instituto de Química Avanzada de Cataluña (IQAC-CSIC), del Consejo Superior de Investigaciones Científicas (CSIC), en colaboración con la Universidad de Burgos y cuenta con la participación del Instituto de Diagnóstico Ambiental y Estudios del Agua (IDAEA-CSIC).
“Lo que se ha hecho”, detalla Roberto Quesada, “en cultivos celulares, es demostrar que la toxicidad de estas moléculas es exclusiva cuando tenemos esas condiciones de pH que se encuentran en el microambiente tumoral. De tal manera que la toxicidad de las moléculas es máxima cuando tenemos ese pH acídico que caracteriza el microambiente tumoral, mientras que su toxicidad es mínima cuando tenemos un pH que es el que se encuentra habitualmente en un tejido sano.”
Estos resultados son relevantes para el desarrollo preclínico de nuevas moléculas transportadoras de iones, llamadas ionóforos, con potencial aplicación terapéutica en el tratamiento contra el cáncer. Se trata de un estudio en fase inicial.
Retos en la lucha contra el cáncer
La quimioterapia contra el cáncer enfrenta dos desafíos principales: la falta de selectividad, que produce efectos secundarios indeseados, y la aparición de quimiorresistencia, ya que las células tienen capacidad de generar resistencia a los agentes químicos que se usan en la quimioterapia, haciendo que los tratamientos sean inefectivos para algunos pacientes.
Hay una evidencia creciente del potencial de los ionóforos como nuevos compuestos en quimioterapias contra el cáncer. Sin embargo, el control de su actividad para limitar su toxicidad ha sido una difícil tarea hasta el momento. El uso de ‘jaulas’ moleculares de este tipo que actúan selectivamente en el pH ligeramente ácido del microambiente de los tumores sólidos es una forma de superar estos obstáculos y avanzar en su desarrollo.
‘Jaulas’ moleculares para destruir células cancerosas
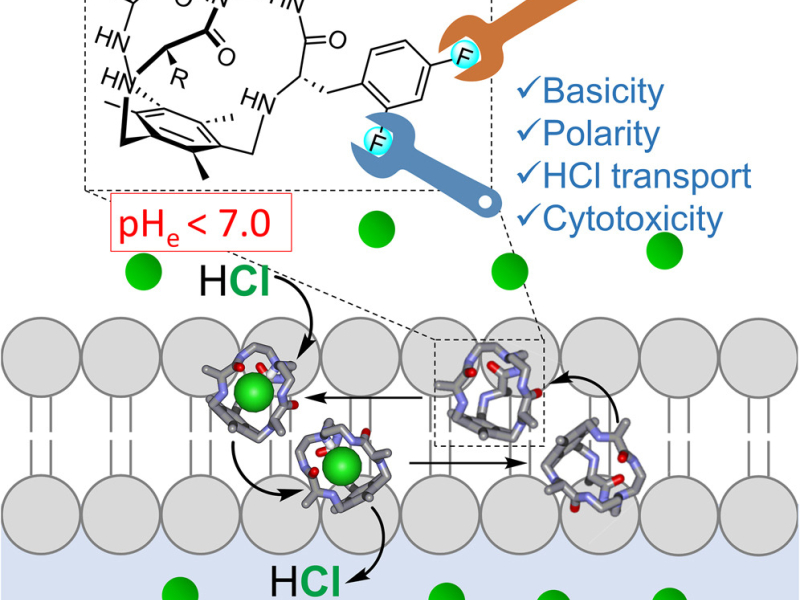
Estas ‘jaulas’, derivadas de aminoácidos sustituidos con flúor, matan las células cancerosas en valores de pH ligeramente ácidos (por debajo de 7, que son las cifras observadas alrededor de los tumores), pero son inocuas para el pH fisiológico de los tejidos sanos. “En un estudio previo, publicado en el 2019, diseñamos una molécula con estructura tridimensional en forma de ‘jaula’ que mostraba buena selectividad para matar células cancerosas en medios ligeramente ácidos”, explica Ignacio Alfonso, investigador del IQAC-CSIC y autor principal del estudio.
“En este trabajo queríamos ir un poco más lejos y entender el mecanismo de acción de estas moléculas”, explica el investigador del IQAC-CSIC. “Para ello, se ha realizado un estudio exhaustivo con una familia amplia de ‘jaulas’ con diferente número de átomos de flúor en distintas posiciones para entender la capacidad de capturar cloruro, el proceso de transporte y la toxicidad a diferentes pHs en cultivos celulares”, aclara Alfonso.
El proceso se ha estudiado exhaustivamente a nivel molecular utilizando enfoques teóricos y experimentales de última generación (fluorescencia, resonancia magnética nuclear y estudios computacionales). Los resultados han permitido entender el mecanismo de acción e identificar una jaula con aún mayor selectividad para matar células de cáncer en entornos ácidos.
“Estos resultados ayudarán a comprender y mejorar el diseño de este tipo de ionóforos con potencial aplicación terapéutica en el tratamiento contra el cáncer”, concluye Roberto Quesada, investigador de la Universidad de Burgos.








